[新しいコレクション] 価電子の数 グラフ 158290-価電子の数 グラフ
この数を〔 原子価 〕という。 例) h 原子と o 原子の電子式 例) n ( k 2 l 5 )の原子価 共有結合と分子 非金属の原子どうしは, 不対電子を出し合って共有電子対をつくることにより結合し,互いに安定な電子配置となる 。この結合を共有結合といい形式酸化数、価電子数 Mn(I) (d6) MeCO (x5) 価電子数 6e 2e 10e 18e Mn (d7) Me CO (x5) 価電子数 7e 1e 10e 18e 金属―配位子間を実線で結ぶ (共有結合を表す) MnMe 中性のMnとMe・が1電子ずつ 出し合って結合を形成 MnCO :CO配位子から2電子 結合に必要な電子対が配位子側波動 関 数は、 φr( ) =φx x( ) φy y( ) φz z( ) の形に か け ると 仮 定する。電子の伝 播 は、どの方 向 に対しても同様の可能性があるため、上の形を 仮 定する。さらに
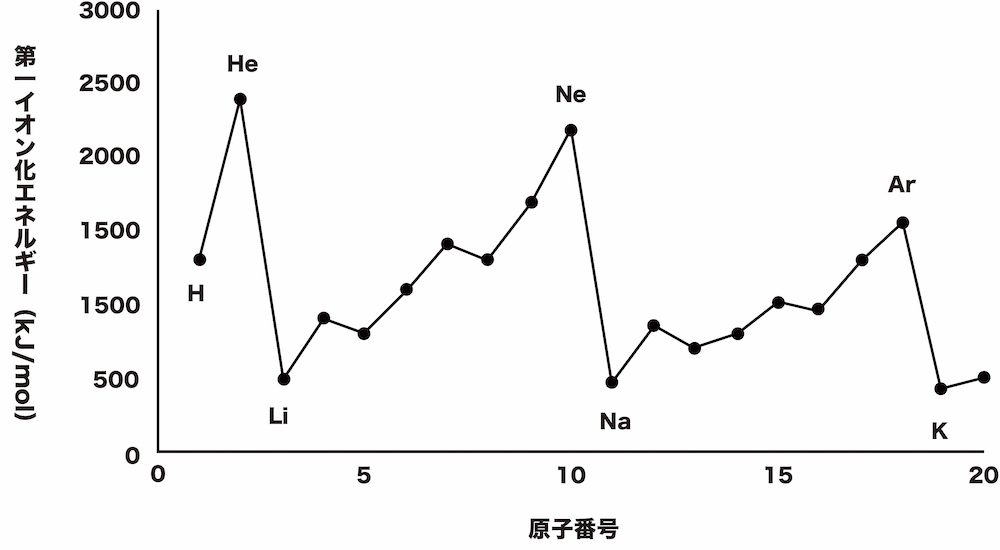
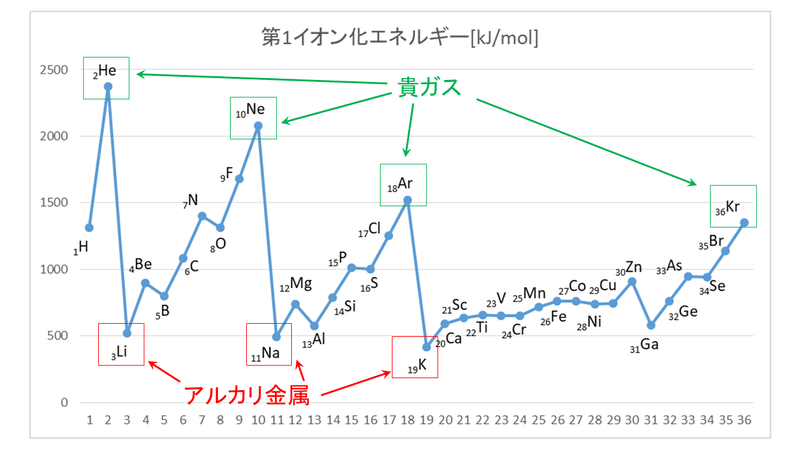
第一イオン化エネルギー 周期表での最大最小 グラフ 電子親和力との違いなど 化学のグルメ
価電子の数 グラフ
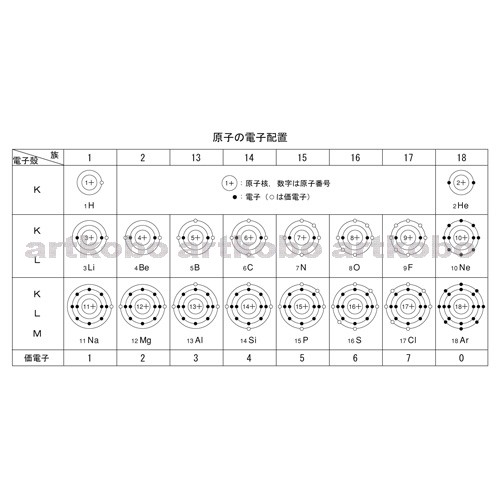
価電子の数 グラフ-価電子帯 ~005eV ドナー準位 伝導帯 価電子帯 qq 電子 ドナー 電子がドナーに束 縛されている状態 ( 原子軌道に似た 状態 ) q 電子がドナーに束 縛されていない状 態 ( mq 真空準位に似た 状態 ) 4 8 22 E h 原子:Rydberg =136 eV Si: = 119 0 1021原子価 結合に関係する 電子 をいい、 価電子 ともいう。 原子 の電子軌道の最外殻にある電子の数がそれにあたる。 一般に原子の電子配置は、基底状態においては内殻から順次詰まっており、最内殻からK殻、L殻、M殻のように 名 づけられている。 各電子殻に収容される電子の個数は、K殻から順次、2、8、18と定まっており、ある原子の電子の数が内殻から



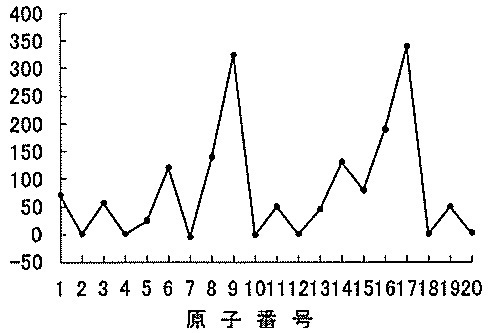
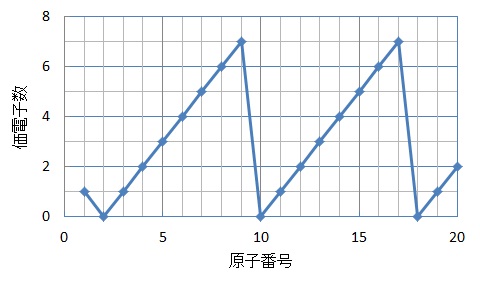
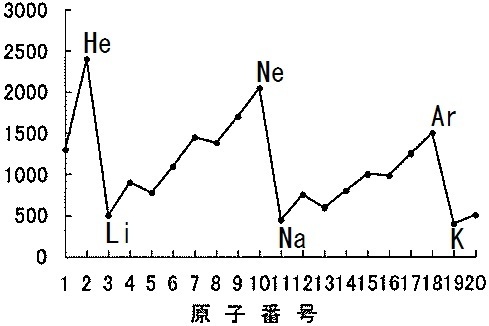
高校化学の分野でこの 7 はなんのグラフでしょうか 横軸は原子番号です こ Yahoo 知恵袋
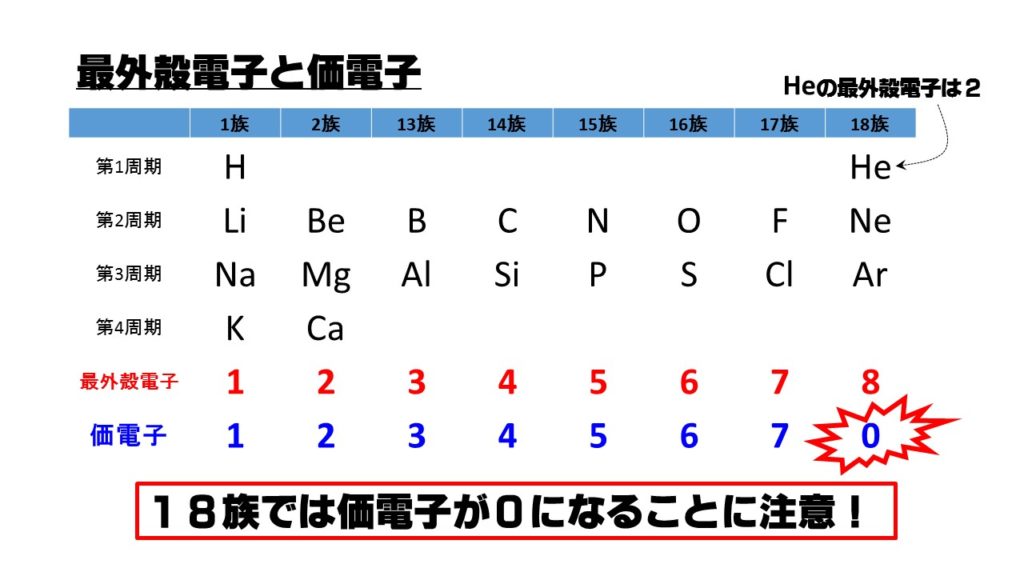
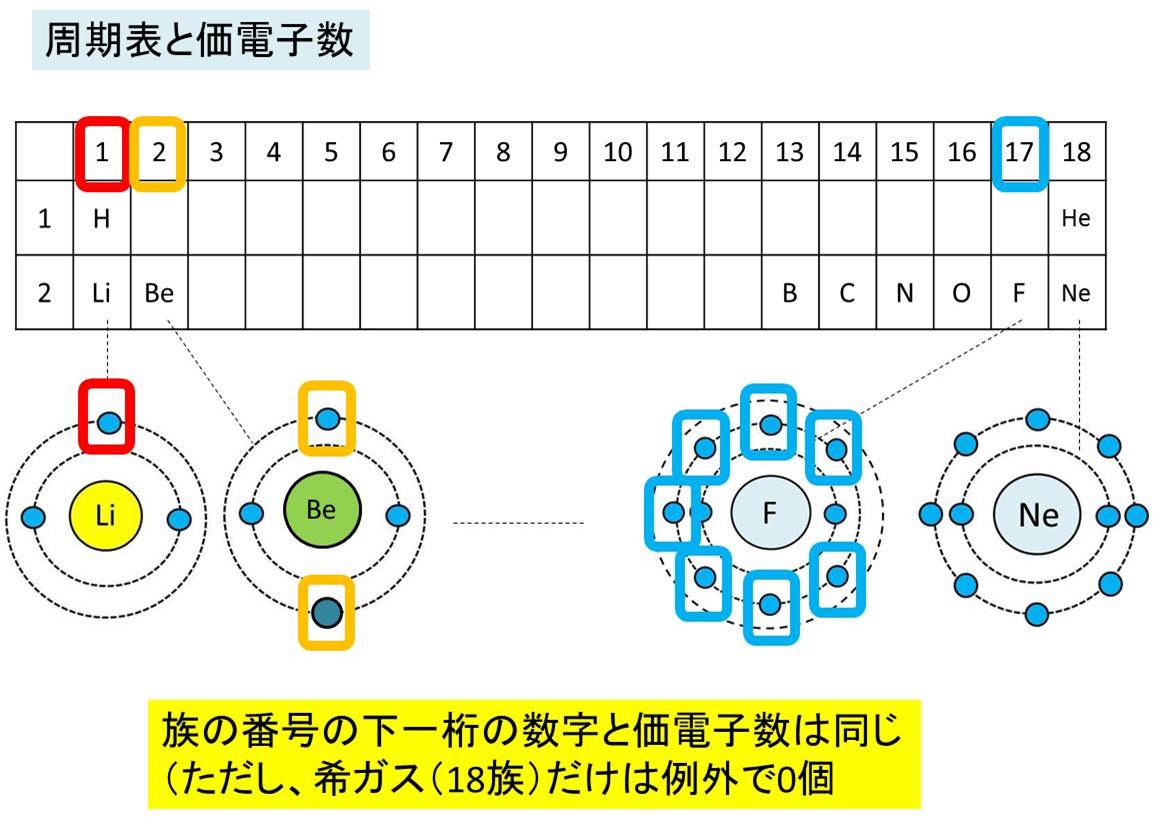
臨界周波数45MHz以上 稚内(北海道) + 国分寺(東京) + 山川(鹿児島) + 大宜味(沖縄) +Oct 13, 18 · 価電子数が4つなので、すべて不対電子となります。 例えば、メタンCH 4 の場合、不対電子4つと水素が共有結合し、4本の共有結合が生じます。 炭素原子Cからは、価標(棒線)が4本出ています。 二酸化炭素CO 2 の場合、二重結合となりますが、同様に炭素原子Cからは、価標(棒線)が4本出ています。最外殻の電子殻にある電子のことです。 基本は上記の電子の数になりますが、最大収容量か8個になる場合価電子の数は0となります。 らき 約2年前 ネオン原子は希ガス原子であり最外殻の電子が最大収容量の8個になっているため0になっています。 たね
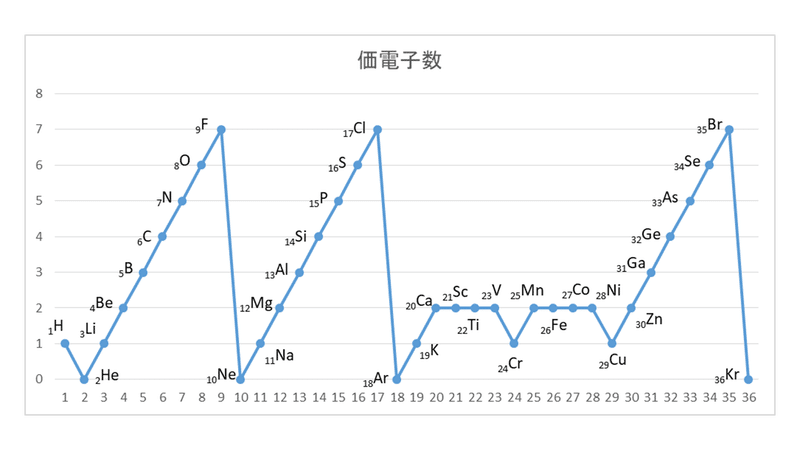
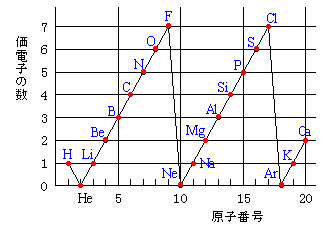
さぁ、元素の性質について考えるために、次のグラフを見てください。 横軸は、 原子番号 になっています。 縦軸は、 価電子の数 になっていますね。 たとえば、原子番号1のH(水素)は、価電子の数が「1」です。 原子番号2のHe(ヘリウム)は、価電子の数が「0」です。 Heは、希ガスだったので、価電子の数は「0」なのですね。 その続きは、次のように順番にCの価電子数= 4 (2s22p2) 例)CO2 1)分子の総価電子数(V)を計算する = 4 (2s Oの価電子数= 6 (2s22p4) 総価電子数 = 42x6 = 16 2)共有結合の数(Nb)を計算する イオンの場合は電荷に応じて増(陰イオン) 減(陽イオン)する Nbc = (8x316)/2 = 4 n原子分子なら Ncb = (8nV)/2Start studying イオン式、価電子数 化学 Learn vocabulary, terms, and more with flashcards, games, and other study tools
希ガスは 安定であるため,価電子の数を0とする。 (1) 同位体 (2) 中性子の数は,(ア):6,(イ):8, (ウ):8,(エ):16,(オ):である。 (イ)と(ウ) (3)40Ca は第4周期に属し,その電子配 置は,K2,L8,M8,N2である。 (オ) (4) (ア)と(イ)の価電子の数は4,(ウ) は6,(エ)は6,(オ)は2である。 (オ) 電子の総数が原子番号に等しいので,(ア)は2He,(イ)は6C,(ウ)は9F, (エ)は11NaJul 08, · 価電子数を求める問題についてです。解説には、s,p,d,fの話が出てきました(それについてはなんとなく知っています)。価電子とは、最外殻に入っている電子の数のことだと思うのですが、どうしてその話がでて価電子 ( かでんし 、 ( 英 valence electron )とは、原子核の周囲に束縛されている電子のうち、最外殻に存在する電子のことである。価電子は、原子間の化学結合などにおいて重要な役割を果たしていることが多く、物質の性質を特徴づける主要な要素である。 原子価電子 ( げんしかでんし ) ともいう。 基本的に、価電子数は最外殻電子数と等しい。



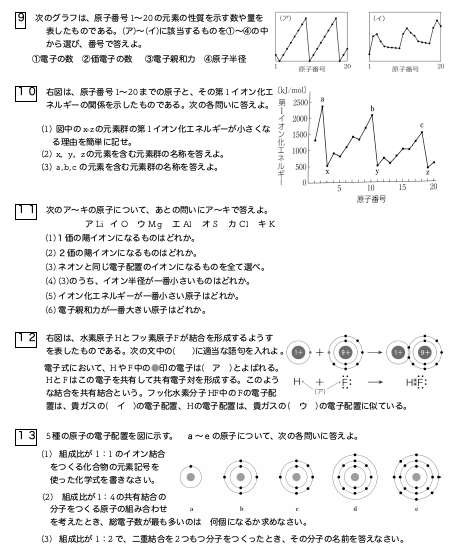
Number 01 16 原子価 原子量 原子番号 Metatronic Metalogue




イオン化エネルギー 電子親和力 電気陰性度のグラフの違いを区別せよ 化学受験テクニック塾
する電子状態は、フェルミ準位に近い価電子帯の頂上と伝導体の底の周辺だけに限られ るので、これらの分散を、図111 のように放物線で近似する。これは、94 節で導入した 近似であり、(918) 式と同様にして、伝導帯の分散を、 Eg = 067 eV Eg = 111 eV Eg = 143 eVこれらを 3/2 電子化合物という。このほか 7/4 電子化合物,21/13 電子化合物も見出されている。ただし価電子総数の計算に VIII族元素 (鉄,コバルトなど) は価電子数0とする。たとえば,FeAl は 3/2 電子Weblio 辞書 > 英和辞典・和英辞典 > 価電子数の意味・解説 > 価電子数に関連した英語例文 例文検索の条件設定 「カテゴリ」「情報源」を複数指定しての検索が可能になりました。



3




イオン化エネルギーと電子親和力まとめ 理系ラボ
電子殻の最大収容電子数 電子殻主量子数 軌道 最大収容電子数 n2n2 K 1 s 2=2・12 L 2 s,p 2+6=8=2・22 M 3 s,p,d 2+6+10=18=2・32 N 4 s,p,d,f 2+6+10+14=32=2・42− 28 − 高校講座・学習メモ 8 電子殻と電子配置 び方は"階差数列"と呼ばれている。電子殻に入り得る電子の最大数は規則正しく増加している。のを( 価電子 )という。最外殻電子の数が1~7個の場合、価電子の数は最外殻電子の数は等しい。 一般に、価電子の数が等しい原子どうしは、よく似た性質を示す。 問2.次の各原子の電子配置を、(例)にならって記せ。また、価電子の数も書け。




電気親和力ってなに イオン化エネルギーや電気陰性度との違いも含めて解説 高校生向け受験応援メディア 受験のミカタ




5 Descubre Como Resolverlo En Qanda
価電子数 (a) (b) (c) (d) (e) (f) (g) 4.周期表 H 図は周期表の各元素群のおおよその分類を示したものである。 (1)典型元素はどの部分か。すべて記せ。 (2)金属元素はどの部分か。すべて記せ。< µ の状態をとる k 空間では k x k y k z V C 基本単位胞の体積 価電子数(最外殻の電子数)=Z 自由電子では球になる 半径=k F 1つのバンドに収容しうる電子数= 2N N:その結晶の含む基本単位胞の数Apr 17, 21 · 18族である希ガスの電子配置は安定的なため、電子が一つや二つ足りないだけの16族や17族は簡単に最外殻電子を1個または2個補充でき、一価の陰イオン(Cl - )や二価の陰イオン(O 2- )などになります。 例えば、 フッ化物イオンの電子配置 F e - → F -




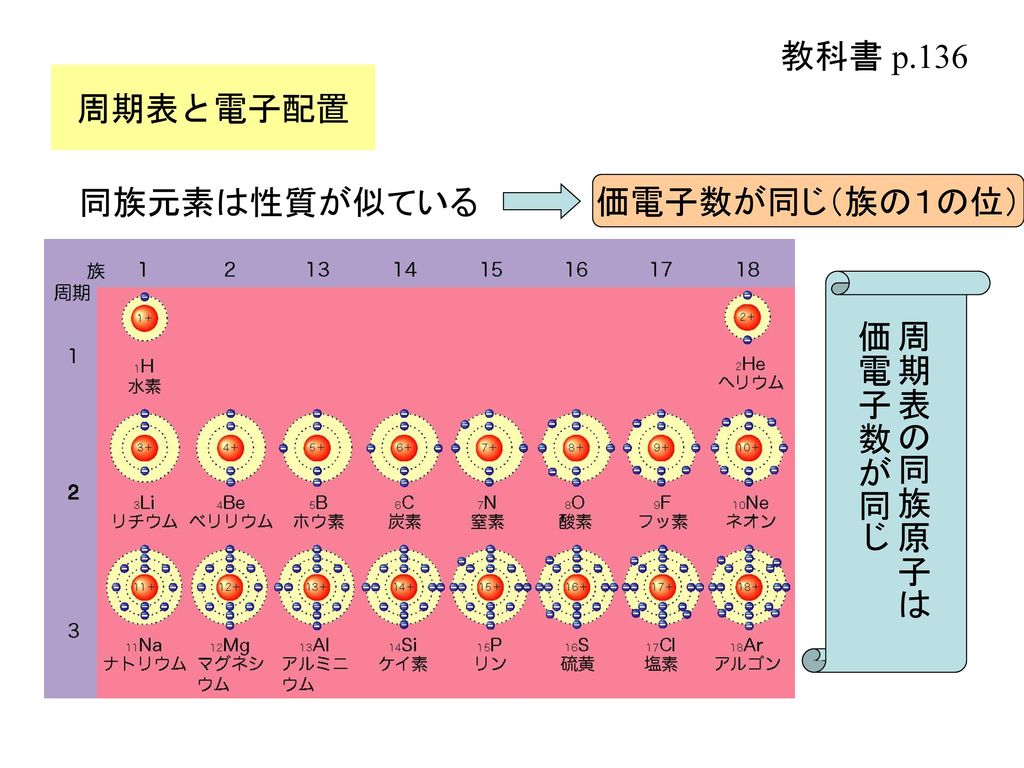
高校化学基礎 周期律と価電子 映像授業のtry It トライイット



高校化学基礎です 次のグラフはそれぞれ何を表しているのか それを Yahoo 知恵袋
価電子は,他の原子と結合するときに,重要なはたらきをします。 このため,価電子の数が同じ原子どうしは,イオンになったり,結合したりするときの化学的な性質がよく似ています。 例えば,周期表の 1族の元素の原子はどれも価電子の数が1個ですが,このうちLi,Na,K,Rb,Cs はどれも金属元素で,1価の陽イオンになりやすく,酸化されやすく,水と反応し「価電子」 とは、 最外殻にある1から7個の電子 のことです。 「価電子」と「最外殻電子」はよく似ていますが、 「1から7個」 というところが非常に重要です。 今回のCとFの場合は、どちらも「1から7個」の中に収まっています。May , 17 · 1,2族の価電子数は、それぞれ1,2。 13,14,15,16,17族の価電子数は、それぞれ3,4,5,6,7。 ただし! 18族の価電子数は例外で0だ。 下の絵と一緒に、理解しておこう。




周期律とグラフ Flashcards Quizlet




メルカリ Chemistry 化学基礎 健康 医学 400 中古や未使用のフリマ
・最外殻電子が6個、4個の場合 (価電子の少ない元素で起きる) fbf f 「bの最外殻電子」=6個 「alの最外殻電子」=6個 ・最外殻電子が10個、12個の場合 (第3周期以降の元素で起きる) oso o o h h f p f f f f 「sの最外殻電子」=12個 「pの最外殻電子」=10個 clalcl cl 16密度の帰属が明確になれば,注 目する原子が何個の電子 を有するか(価 数)を 見積ることができる(3)式 をR で微分すると,球平均した電子密度が得られ,半 径Rと R Rと の間の球殻の電子密度が動径分布の形で求ま るYBa2Cu3O6δ 中のCu原 子の例を図2に 示す2種 類<不活性電子対効果> 「周期律表で遷移金属に続く典型元素が、しばしば小さい (価電子数2) 酸化数をとること」 ("ns 電子対が不活性である" の意) ex) Sn (Kr5s 2 4d 10 5p 2 価電子4) の2価化合物 Sn II (SnCl 2) / Tl I 解釈 ns (n1 の動径節) np (n2 の動径節)




高品質 定番人気 Mk5952bradshaw マイケルコース 時計 Michael Kors Michaelkors Gift Time クロノグラフ Unisex メンズ レディース



理論 イオン化エネルギーも注意 イオン 受験 定期テストで高校化学を完全攻略
ンゾーンに入り得る電子数は一般に格子点数の2 倍と なる。(原子数の2 倍とは限らないことに注意!) さて、各格子点に1 個の価電子を持った原子を置き、 その電子が自由電子として結晶中を動き回るとすれば、 そのエネルギーはk2 に比例するので、全主量子数n 方位量子数l シリコン電 子数 最大 電子数 軌道 2章 10 真性半導体のエネルギー帯図 バンドギャップEgが小さいほど抵抗率が小さい ρ(Ωcm 05 23X103 ~103 ~1012 Eg(eV) 066 111 143 6~7 @300K Ge Si GaAs C(ダイアモンド) 正孔 伝導電子 伝導帯 価電子帯あり,最外殻電子の数と価電子の数は同じになる。希ガス の場合は,最外殻電子の数はヘリウムで2 個,それ以外で は8 個であるが,価電子の数は0 となる。 問1 7n k 殻;2 個,l 殻;5 個,m 殻;0 個 18 ar k 殻;2 個,l 殻;8 個,m 殻;8 個 問2 7n 5 個




Dfrac 3 Left 1right 2y Descubre Como Resolverlo En Qanda




価電子数を求める方法 12 ステップ 画像あり Wikihow
Sep 14, 18 · なので、大抵の場合は 最外殻電子=価電子 です。 このように炭素の場合は、最外殻電子数と価電子数が同じく4個です。 カルシウムは、このように最外殻電子数2個で価電子数が2個で同数です。 最外殻電子と価電子に違いが出るときは?Apr , 21 · 価電子数と原子価の違い 価電子とは最外殻に存在する電子の数のことです。 価電子数が4個までであれば、原則すべて不対電子として存在するため価電子数と不対電子の数が一致し、他原子と結合した際、価標の数とも一致します。 例:炭素原子内の電子間相互作用 ある電子と原子核とのクーロン引力を考える。 Z eff = Zs s 遮蔽定数 その電子と同じ軌道にある電子も、内側にある電子も、 その電子が受ける核の引力を遮蔽する。→ 遮蔽効果 s 1s = s 2s = 172 s 2p = 258 N 各軌道上の電子数 有効核




5 6 Lihat Cara Penyelesaian Di Qanda



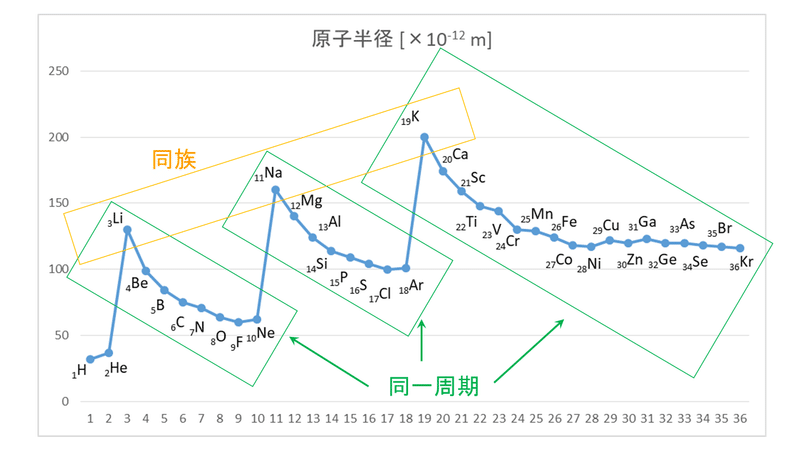
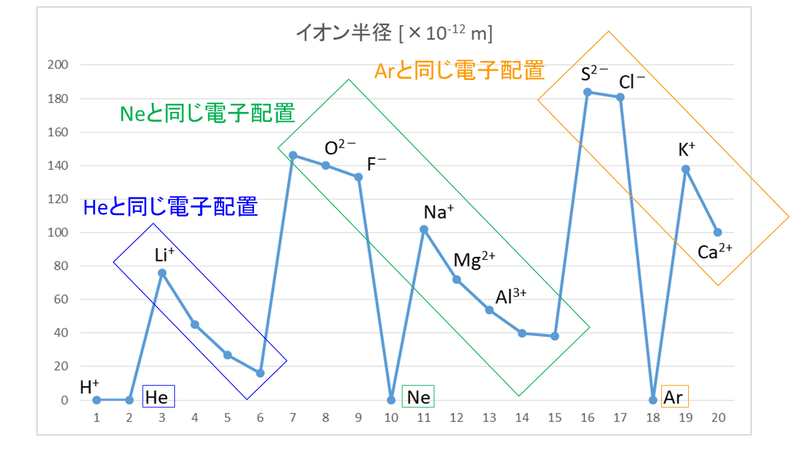
高校化学このグラフ 原子半径を表したものなのですが原子半径って原子 Yahoo 知恵袋
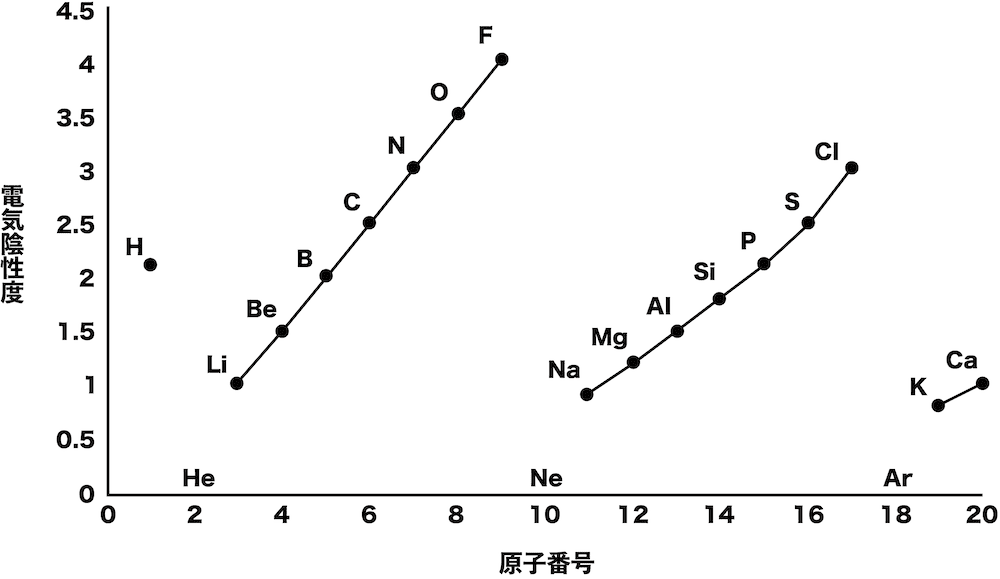
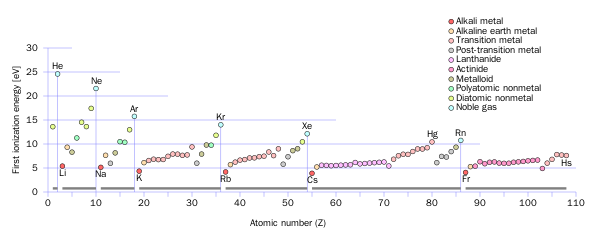
Ni は10 族で10 個の価電子 をもつ.2 電子を失うと,3d 軌 道にある8 電子が残る. 全電子数が28 になっている ことを確認しよう. 全電子数が25 になっている ことを確認しよう.Jan 02, 15 · 化学イオン化エネルギー、電気陰性度、電子親和力のグラフがそれぞれあるとして、見分け方を教えてください イオン化エネルギーとは原子から電子1個取って一価の陽イオンにするのに必要なエネルギーのことを言います。アルカリ金属元素は価電子数が1なので電子を1つ取れば陽イオンに




原子構造と電子配置 価電子 理系ラボ
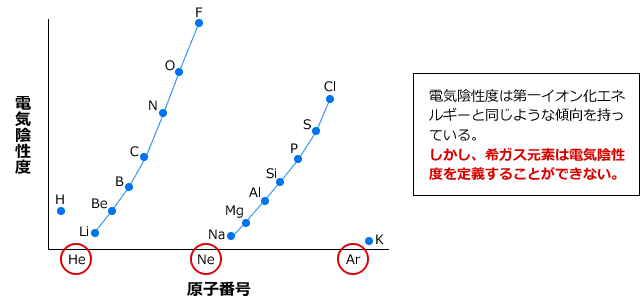



化学講座 第5回 電子親和力 電気陰性度 私立 国公立大学医学部に入ろう ドットコム




高校理論化学 原子の電子配置 受験の月




Wo16 号 熱電変換材料 Astamuse



Http Functfilm Es Hokudai Ac Jp Wp Content Uploads 17 02 Device3 Pdf



高校化学の分野でこの 7 はなんのグラフでしょうか 横軸は原子番号です こ Yahoo 知恵袋
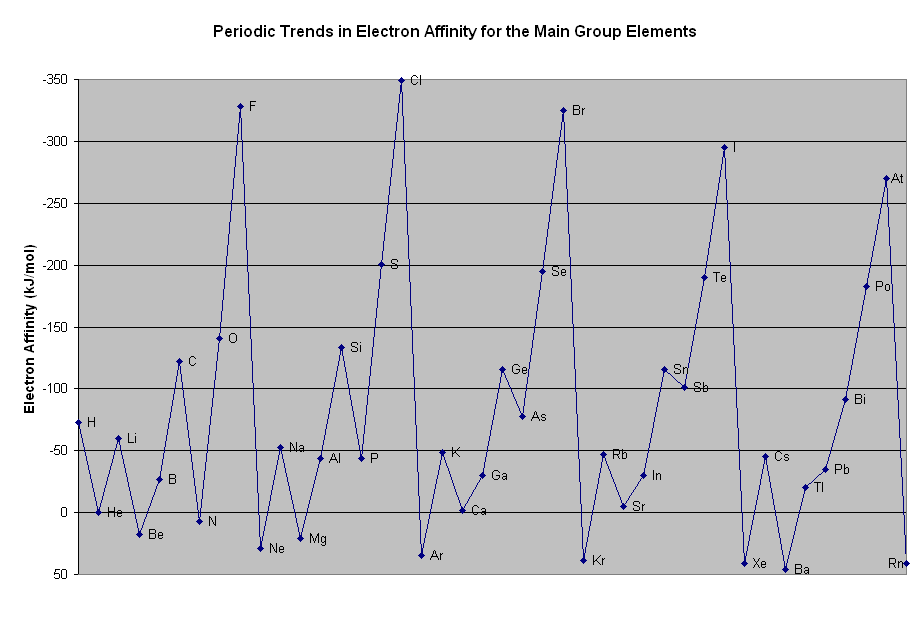



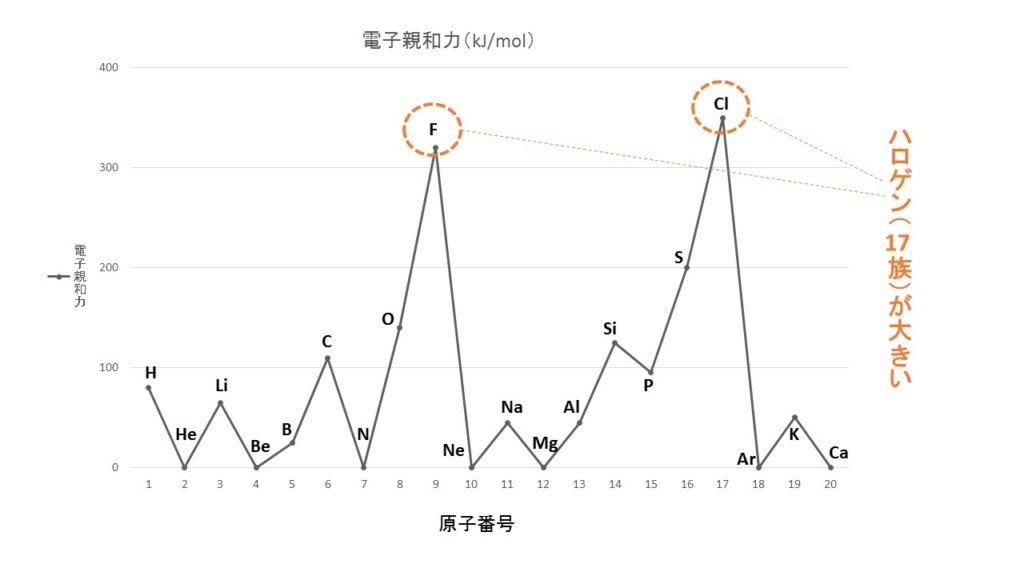
3分でわかる 電子親和力の定義と大小関係の考え方とその理由を図でわかりやすく解説 サイエンスストック 高校化学をアニメーションで理解する



Http Www Touohgakkan Jhh Ed Jp Wp Content Uploads 05 D0fcfdea6dbafbf3f438c0553f0180cc Pdf



Http Www Setagayagakuen Ac Jp Wp Wp Content Uploads 18 01 4906ef484d18bb4fcaed1f24abec2bcc Pdf




周期律とグラフ Flashcards Quizlet



Www Meigaku Ac Jp Wp Content Uploads 04 78b5d3e712fb0c0a2cedb65a0384 Pdf




イオン化エネルギー 電子親和力 電気陰性度のグラフの違いを区別せよ 化学受験テクニック塾
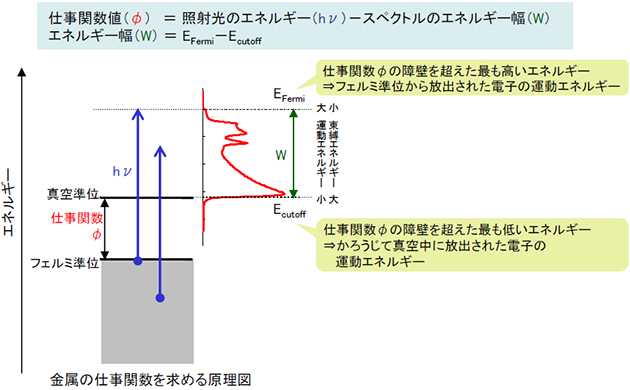



Mst Ups 紫外光電子分光法



グラフとチャートのタイプ Labview 18ヘルプ National Instruments




画像は原子半径のグラフの画像なのですが この問題集のグラフとgoogl 高校 教えて Goo
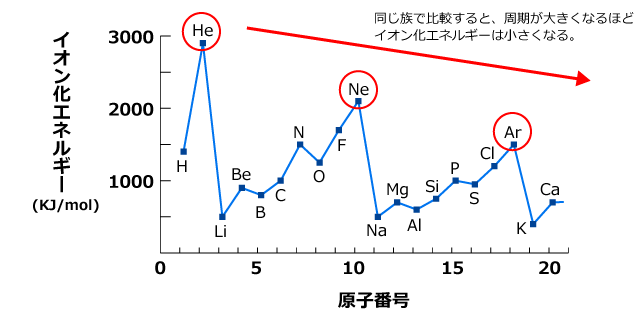



化学講座 第4回 第一イオン化エネルギーと第nイオン化エネルギー 私立 国公立大学医学部に入ろう ドットコム




21共通テスト 化学基礎 解説とまとめ 番外編 しんぞう先生の高校生物




230 1 Lihat Cara Penyelesaian Di Qanda
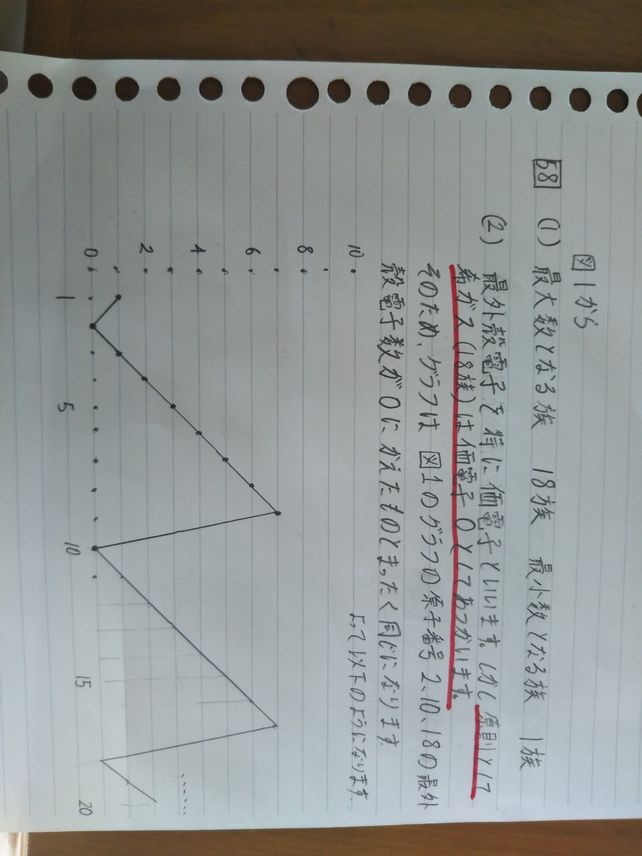



58 110 210 1 8 4 10 15 Lihat Cara Penyelesaian Di Qanda



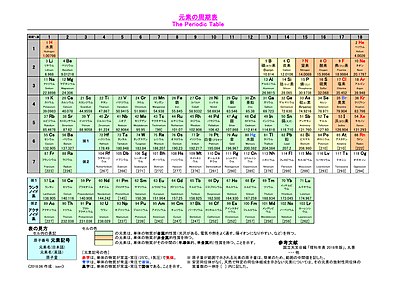
周期表 化学基礎 高校化学net参考書



物理化学学生実験室 5固体の光学特性



周期表をカラーで打ち出して持って行くこと 提示装置を使って示すと黒板に描く必要なし 授業評価アンケート 化学第2第13回 2月03日 授業ノート 浸透と遮蔽 主量子数が2の軌道にはl 0のs軌道とl 1のp軌道がある 水素原子において




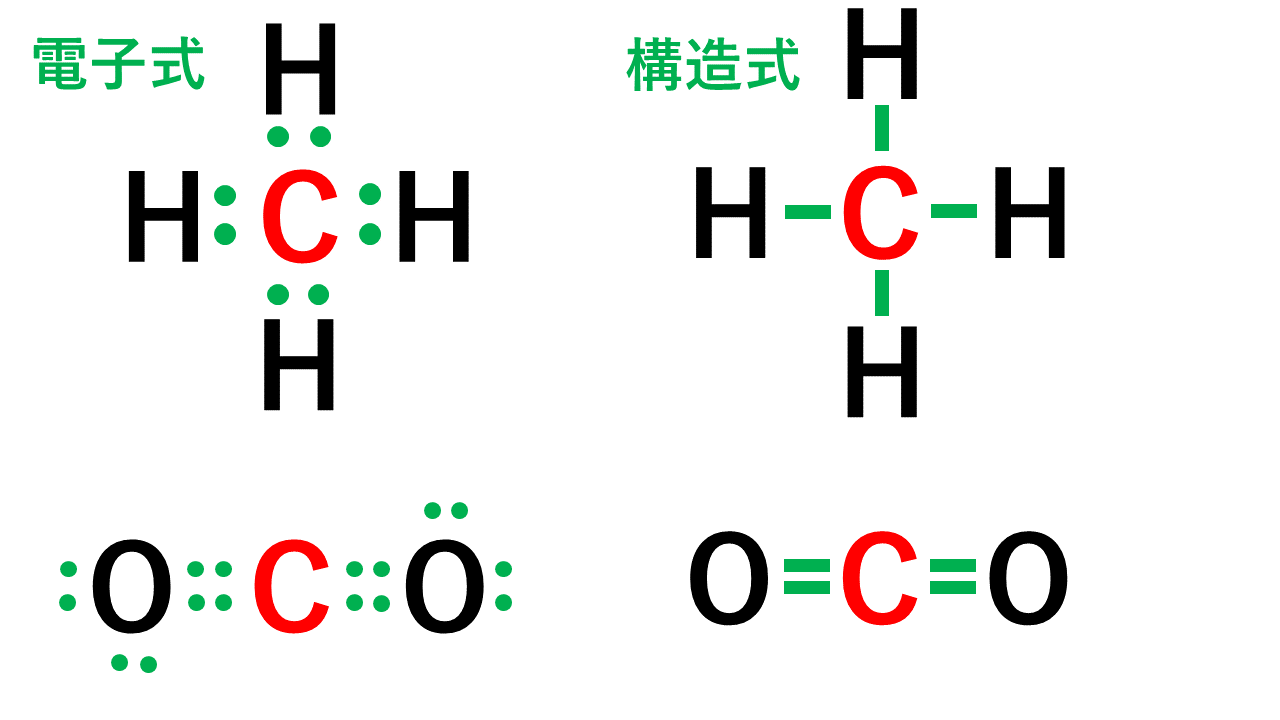
電子式 イオン式から配位結合 錯イオンの仕組みまでわかりやすく解説
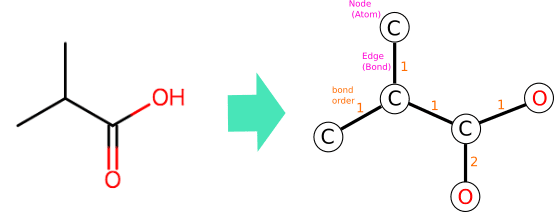



化学構造とグラフ理論 2 分子グラフモデル Mojaie Github Io
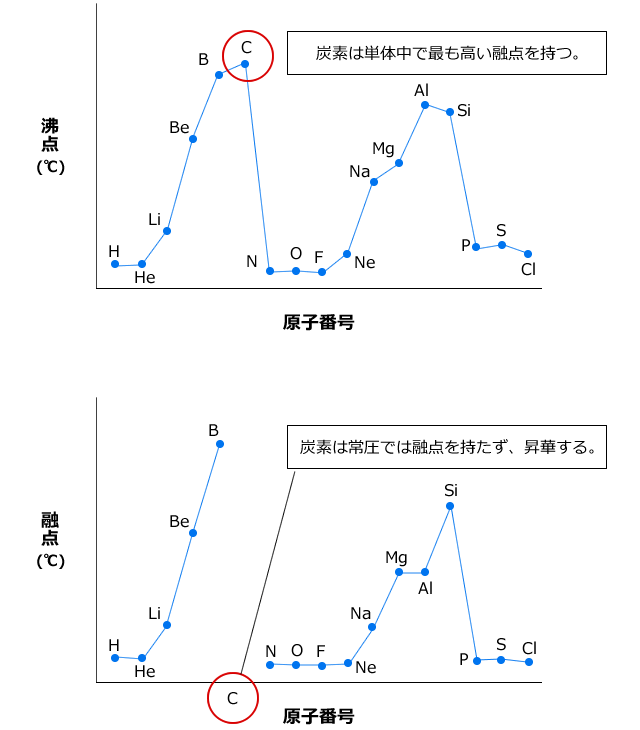



化学講座 第9回 共有結合性結晶と分子性物質 私立 国公立大学医学部に入ろう ドットコム



原子価の意味と一覧 価電子 価標の違い Vicolla Magazine



化学重要問題集8 11 原子 イオン Tekibo



重い電子系の赤外分光研究



Q Tbn And9gct2kjzflwnhsaxoolbww0wtjjkb 0ntuszb Atdhungylgoed 5 Usqp Cau




半導体 高校物理をあきらめる前に 高校物理をあきらめる前に




価電子数を求める方法 12 ステップ 画像あり Wikihow



1 6 元素の周期律と周期表 おのれー Note



1 6 元素の周期律と周期表 おのれー Note




原子核や質量数 同位体の語呂合わせ 陽子数 中性子数 原子番号など 18h30大学入学共通テスト試行調査第2回第1問c 問5 語呂合わせで高校化学 大学入試ゴロ化学



価電子とは 数え方や覚え方 最外殻電子との違いは




価電子とは 価電子数の数え方をやさしく説明するよ 授業 レベルa2 ともよし塾 受験と科学の解説授業




価電子数と最外殻電子数 高校物理 高校化学家庭教師 ズバリ教えます



第1イオン化エネルギー 化学基礎 高校化学net参考書




ア は になるのはなぜですか Clear



Http Functfilm Es Hokudai Ac Jp Wp Content Uploads 17 02 Device3 Pdf



電子 親和力 グラフ 化学講座 第5回 電子親和力 電気陰性度
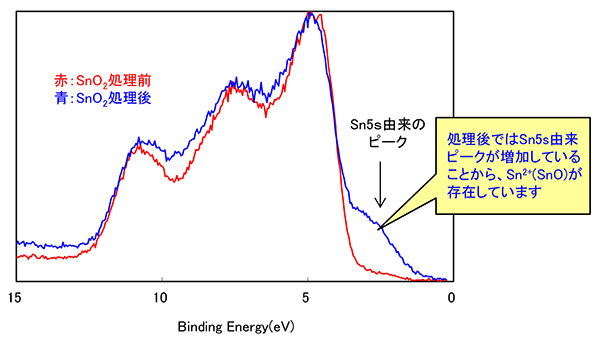



Mst Xpsによるsn酸化物の価数評価 C0492



前後見返し 元素の周期表




周期律とグラフ Flashcards Quizlet
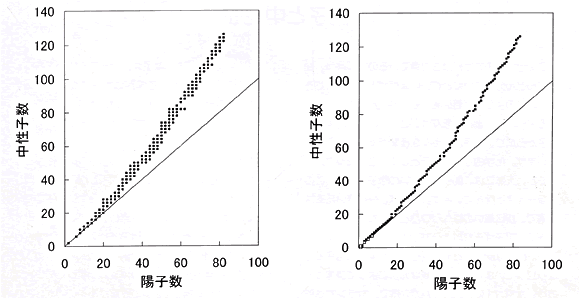



第62号 陽子と中性子



文系化学基礎2単位 期末試験問題 高校化学の教材 分子と結晶模型の ベンゼン屋 楽天ブログ




電子 親和力 グラフ 化学講座 第5回 電子親和力 電気陰性度



Qck0d2a9as2853cudbqy0lc6cfz4a0e7e Xyz Kiso Differences Of Graph




高校化学基礎 周期律と価電子 映像授業のtry It トライイット



元素の周期表 教科書 P 元素を 原子番号 順に並べる 性質の良く似た元素がある周期で現れる 元素の周期律 周期表 Ppt Download



第一イオン化エネルギー 周期表での最大最小 グラフ 電子親和力との違いなど 化学のグルメ



科学 化学 Pararinpoppin In Hell



Www Daiichi G Co Jp Pr Tb Doc Pdf 6608 E5 8c 96 E5 Ad A6 E5 9f Ba E7 8e E6 96 B0 E5 8c 96 E5 Ad A6 E5 9f Ba E7 8e E6 8c 87 E5 B0 8e E7 94 A8 E8 87 E6 96 99 81 Ae 81 94 E6 A1 E5 86 85 Pdf
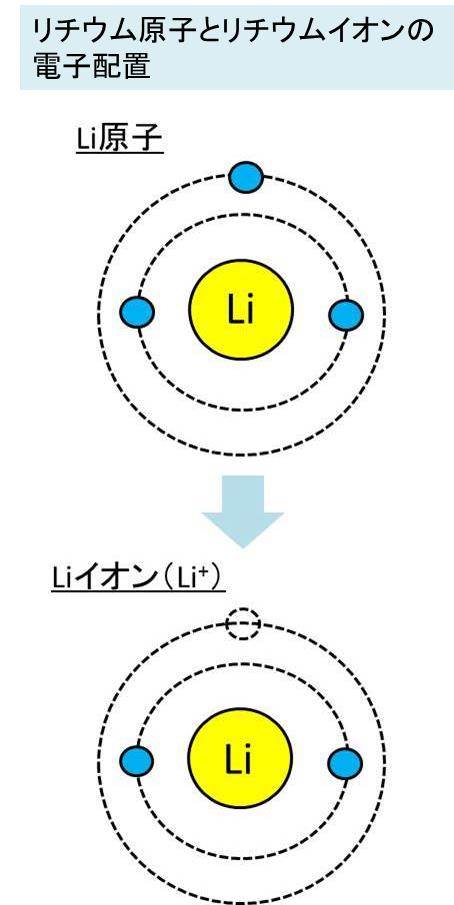



価電子とは 数え方や覚え方 最外殻電子との違いは




なんでこの答えになるのか 解説欲しいです Clear




なぜヘリウムは電子の数か2個なのに価電子は0個なんですか なぜヘリ 高校 教えて Goo




イオン化エネルギー 電子親和力 電気陰性度のグラフの違いを区別せよ 化学受験テクニック塾




イオン化エネルギーと電子親和力まとめ 理系ラボ



Q Tbn And9gcsehw5cwcaw6di4o3vedvsm7lzfqsols7n4fsxrmqq C2oljibh Usqp Cau




高校化学基礎 周期律と価電子 映像授業のtry It トライイット



Web教材イラスト図版工房 R Ch 物質の基本構成 26
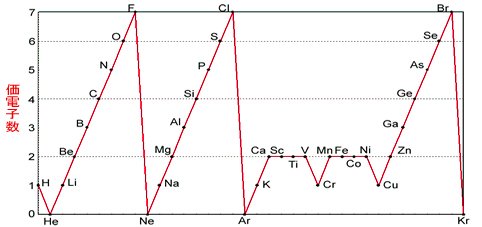



未知なる人間 遥かなる宇宙 Twitter वर 最外殻電子数と価電子数 最外殻電子数とは 単純に最外殻にある電子数です 価電子 とは 反応に関与する電子数です 下図は価電子のグラフです 最外殻電子数のグラフとの違いを考えて下さい T Co




イオン化エネルギー 電子親和力 電気陰性度のグラフの違いを区別せよ 化学受験テクニック塾



高校化学の分野でこの 7 はなんのグラフでしょうか 横軸は原子番号です こ Yahoo 知恵袋




化学基礎模試解説 Kumonotaira
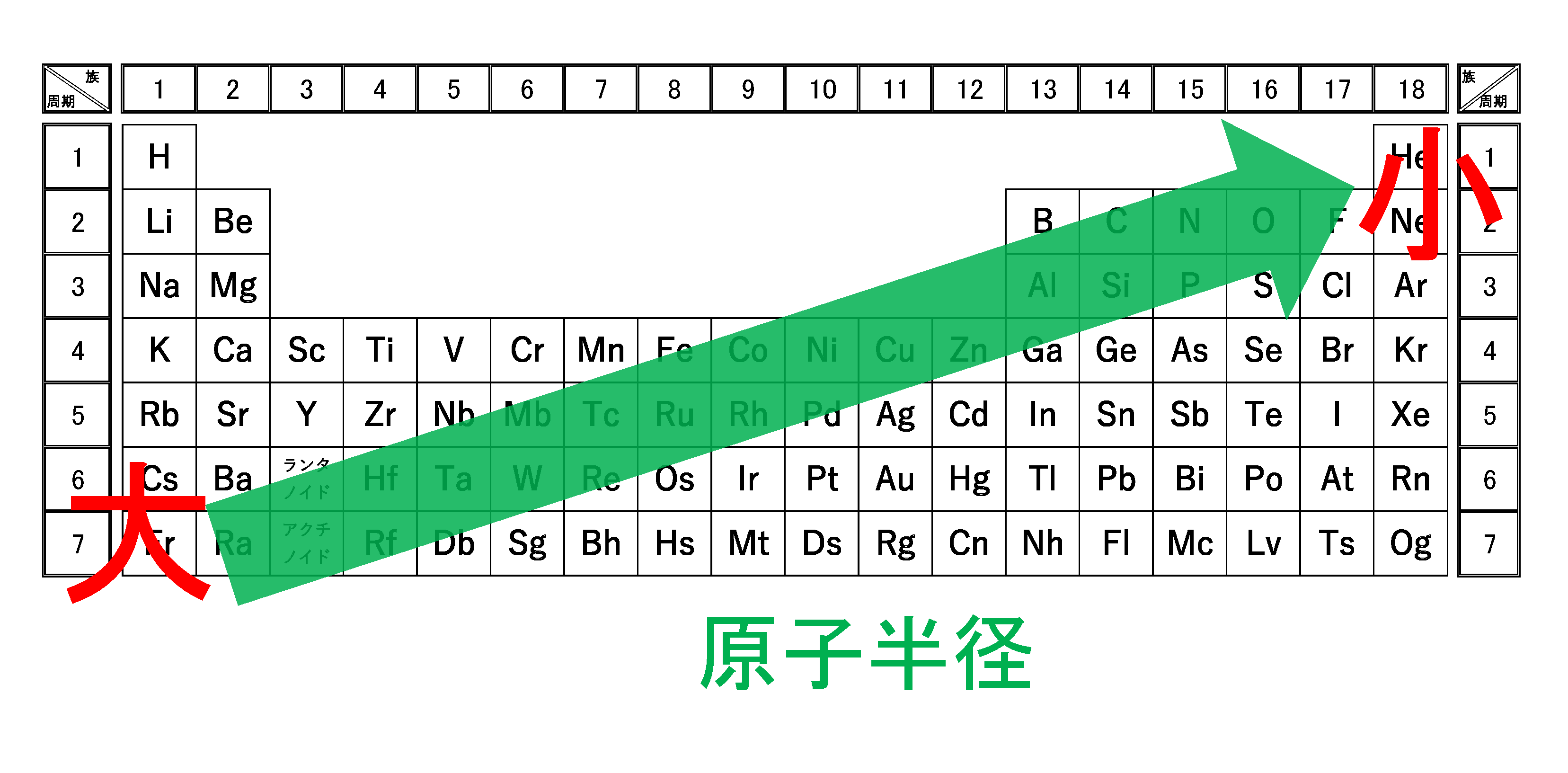



3分でわかる 原子半径 原子の大きさ の周期表での大小関係とその理由を図で徹底解説 サイエンスストック 高校化学をアニメーションで理解する



1 6 元素の周期律と周期表 おのれー Note




10 号 表面改質された樹脂フィルム 及び樹脂フィルムの表面改質方法 Astamuse




第一イオン化エネルギー 周期表での最大最小 グラフ 電子親和力との違いなど 化学のグルメ



1 6 元素の周期律と周期表 おのれー Note




が分からないので教えてください Clear




周期律とグラフ Flashcards Quizlet




高校 化学基礎 全部教えてください 解説はなくても結構です Clear




高校化学基礎 周期律と価電子 映像授業のtry It トライイット




21共通テスト 化学基礎 解説とまとめ 番外編 しんぞう先生の高校生物




5分でわかる 陽イオン 陰イオン 単原子イオン の価数の考え方と覚え方 電子配置を図で解説 サイエンスストック 高校化学をアニメーションで理解する



周期表 Wikipedia



Yms Ne Jp Wp Content Uploads 04 Yms C Muki Pdf




Wo16 号 熱電変換材料 Astamuse




高等学校化学基礎 物質の構成 Wikibooks



Www Kyoto Be Ne Jp Katsura Hs Cms Action Common Download Main Upload Id 9573




原子構造と電子配置 価電子 理系ラボ



周期表 Wikiwand




価電子とは 価電子数の数え方をやさしく説明するよ 授業 レベルa2 ともよし塾 受験と科学の解説授業



化学重要問題集8 11 原子 イオン Tekibo
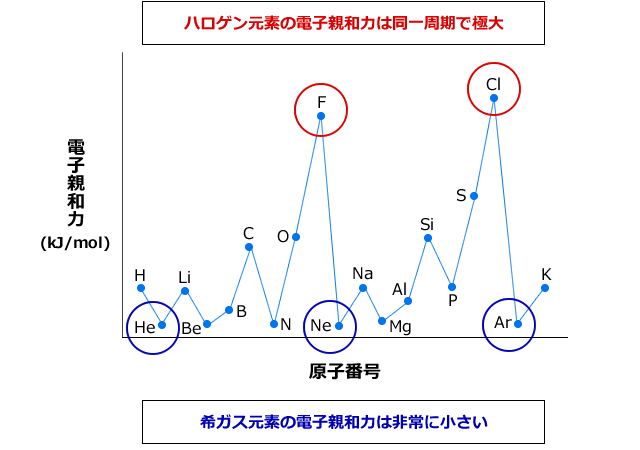



化学講座 第5回 電子親和力 電気陰性度 私立 国公立大学医学部に入ろう ドットコム



1



鹿農日記 熊本県立鹿本農業高等学校


コメント
コメントを投稿